 BTC/HKD+1.05%
BTC/HKD+1.05% ETH/HKD+0.8%
ETH/HKD+0.8% LTC/HKD+0.05%
LTC/HKD+0.05% ADA/HKD+1.69%
ADA/HKD+1.69% SOL/HKD+4.28%
SOL/HKD+4.28% XRP/HKD+1.08%
XRP/HKD+1.08% 
撰文|王志編輯|LZ
生物醫藥二月批簽發與臨床動態(2021年2月8日-2021年3月11日)
一、批簽發
13價肺炎球菌多糖結合疫苗批簽發量190.17萬支。其中,沃森生物獲批簽發49.32萬支。
23價肺炎球菌多糖疫苗批簽發量148.82萬支。其中,北京民海生物獲批簽發63.22萬支,沃森生物獲批簽發12.69萬支。
A群C群腦膜炎球菌多糖結合疫苗批簽發量108.36萬支。其中,北京智飛綠竹獲批簽發54.72萬支,沃森生物獲批簽發53.64萬支。
b型流感嗜血桿菌結合疫苗批簽發量12.19萬支,全屬沃森生物。
無細胞百白破b型流感嗜血桿菌聯合疫苗批簽發量95.32萬支,全屬北京民海生物。
凍干人用狂犬病疫苗批簽發量384.01萬瓶。其中,成大生物獲批簽發103.57萬瓶。
凍干人用狂犬病疫苗批簽發量16.4萬瓶,全屬康華生物。
水痘減活疫苗批簽發量244.17萬瓶。其中,科興大連獲批簽發13.88萬瓶;百克生物獲批簽發91.28萬瓶。
四價流感病裂解疫苗批簽發量60.66萬瓶,全屬擬上市公司金迪克。
ACYW135群腦膜炎球菌多糖疫苗批簽發量60.13萬瓶。其中,北京智飛綠竹獲批簽發31.11萬瓶;沃森生物獲批簽發29.03萬瓶。
乙型肝炎病表面抗原診斷試劑盒批簽發量9.74萬盒。其中,萬泰生物獲批簽發5.14萬盒;中山生物工程獲批簽發3962盒;華大吉比愛獲批簽發5935盒;科華生物獲批簽發1.34萬盒;珠海麗珠試劑獲批簽發1.1萬盒。
重組乙型肝炎疫苗批簽發量219.01萬支,全屬康泰生物。
丙型肝炎病抗體診斷試劑盒批簽發量8.59萬盒。其中,科華生物獲批簽發8636盒;華大吉比愛獲批簽發9917盒;珠海麗珠試劑(麗珠集團控股子公司獲批簽發8959盒;萬泰生物獲批簽發3.75萬盒。
梅螺旋體抗體診斷試劑盒批簽發量10.01萬盒。其中,科華生物獲批簽發1.73萬盒,萬泰生物獲批簽發5.2萬盒;珠海麗珠試劑獲批簽發1.1萬盒。
人類免疫缺陷病抗體診斷試劑盒批簽發量5.78萬盒。其中,萬泰生物獲批簽發3.93萬盒;華大吉比愛獲批簽發9985盒;科華生物獲批簽發8562盒。
吸附破傷風疫苗批簽發量26.11萬瓶,全屬擬上市公司歐林生物。
a16z生物+健康基金與Bassett合作利用數字醫療技術:金色財經報道,Andreessen Horowitz(a16z)生物+健康基金今天宣布與紐約州中部的綜合醫療保健系統Bassett Healthcare Network建立戰略合作伙伴關系。這項合作旨在利用a16z投資組合公司的數字醫療技術,通過Bassett Healthcare Network解決向農村患者群體提供高質量醫療服務的不平等和系統性挑戰。Bassett醫療集團和a16z已經為這種合作關系成立了一個執行委員會,以探索創新技術和平臺,調整優先事項,并監督相關技術改造的實施。(businesswire)[2022/11/8 12:30:19]
腸道病71型滅活疫苗批簽發量136.34萬瓶,全屬北京科興生物。
人類免疫缺陷病抗原抗體診斷試劑盒批簽發量1.28萬盒,全屬萬泰生物。
甲型肝炎滅活疫苗批簽發量165.92萬支,全屬北京科興生物。
人用狂犬病疫苗批簽發量28.64萬瓶,全屬大連雅立峰。
雙價人乳頭瘤病疫苗批簽發量15.23萬瓶,全屬廈門萬泰。
A群C群腦膜炎球菌多糖疫苗批簽發量130.3萬瓶。其中,沃森生物獲批簽發60.13萬瓶。
人凝血酶原復合物批簽發量6576瓶,全屬博雅生物。
二、臨床動態
百奧泰在研藥品司庫奇尤單抗注射液收到國家藥監局《臨床試驗批準通知書》,該藥物是百奧泰開發的生物類似藥,其活性成分是中國倉鼠卵巢細胞表達的IgG1kappa亞型單克隆抗體,能以高親和力特異性地結合人白介素17A(IL-17A)和人白介素17A/F(IL-17A/F),從而抑制白介素17介導的自身免疫炎癥反應。
目前,已獲批上市的司庫奇尤單抗藥物為諾華制藥的Cosentyx。百奧泰為首家在中國獲得司庫奇尤單抗生物類似藥臨床試驗批準的公司。
貝達藥業在研產品BPI-D0316膠囊取得藥品注冊Ⅱ期臨床試驗總結報告,該藥物是第三代表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)。截至目前,已有奧希替尼和阿美替尼兩款第三代EGFR-TKI獲得批準及上市。
科倫藥業控股子公司四川科倫博泰開發的創新藥物SKB337注射液獲得國家藥監局臨床試驗通知書,該藥物是公司自主研發的,具有知識產權的腫瘤免疫檢查點新一代雙特異抗體。未來在實體瘤和血液瘤領域,有望與公司已有管線KL-A167等腫瘤免疫藥物形成優勢互補。
截至目前,全球尚無同靶點雙抗藥物獲批上市,公司在SKB337注射液項目上已投入研發費用約2368萬元。
紐約居民指責比特幣采礦廠正在加熱湖泊并可能殺死湖中生物:紐約居民擔心Greenidge的比特幣采礦廠對環境的影響,聲稱該公司正在加熱湖泊并可能殺死海洋生物。
Greenidge工廠每天被允許從湖中抽取1.39億加侖的水并排放1.34億加侖的水。德累斯頓居民對湖溫升高表示擔憂。棲息在湖中的鱒魚物種的可持續性是當地人的一個主要關注點,魚類在52華氏度至64華氏度之間的溫度下茁壯成長,而高于75華氏度的水平對某些物種來說是致命的。該工廠位于紐約德累斯頓,目前能夠吸收大約41兆瓦(MW)的電力,Greenidge計劃到2022年將其產能擴大到85MW。(cointelegraph)[2021/7/6 0:30:06]
恒瑞醫藥子公司山東盛迪收到國家藥監局核準簽發關于HR20005凝膠的《藥物臨床試驗批準通知書》,將于近期開展用于緩解成人靜脈穿刺痛的臨床試驗。該藥物目前已累計投入研發費用約為714萬元。
目前,針對靜脈留置針穿刺鎮痛,國內外有貼劑、乳膏劑和無針粉末經皮注射給藥制劑等多種劑型獲批上市。
百奧泰終止BAT8001臨床試驗。截至2020年12月,該藥物研發項目累計投入2.26億元。據其披露“按照相關會計準則和公司會計政策,該項目的全部研發支出已計入相應會計期間損益。”
百奧泰終止BAT8003和BAT1306臨床試驗。截至2020年12月,公司BAT8003研發項目累計投入6156.5萬元,BAT1306研發項目累計投入5197.45萬元。
微芯生物西奧羅尼膠囊收到國家藥監局簽發的IND《受理通知書》。該藥物是公司自主設計和研發的具有全球專利保護的新化學結構體,屬于多靶點多通路選擇性激酶抑制劑。屬于小分子抗腫瘤原創新藥,可選擇性抑制AuroraB、CSF1R和VEGFR/PDGFR/c-Kit等多個激酶靶點。
復星醫藥控股子公司Novelstar收到美國FDA關于同意NS002片用于炎性關節病治療進行臨床試驗的函,Novelstar擬于近期條件具備后于美國開展該新藥針對上述適應癥的BA臨床試驗。截至2020年12月,復星醫藥對該新藥累計研發投入折合人民幣約602萬元。
君實生物與微境生物共同投資的蘇州君境生物收到國家藥監局核準簽發的《受理通知書》,XPO1抑制劑WJ01024片的臨床試驗申請獲得受理。JS110是核輸出蛋白XPO1的小分子抑制劑,臨床上擬用于治療晚期腫瘤病人。公司擁有JS110在全球范圍內的獨家生產權、委托生產權及銷售權。
君實生物與微境生物共同投資的蘇州君境生物收到國家藥監局核準簽發的《受理通知書》,EGFR非常見突變抑制劑AP-L1898膠囊的臨床試驗申請獲得受理。該藥物是一種有效抑制EGFR非常見突變的靶向小分子抑制劑。公司擁有JS111在全球范圍內的獨家生產權、委托生產權及銷售權。
動態 | Raonsecure與韓國軍方合作提供基于區塊鏈的生物識別和身份驗證解決方案:金色財經報道,韓國軍方人士管理局已與韓國領先的ICT安全軟件公司之一Raonsecure合作,為韓國軍方提供了基于區塊鏈的生物識別和身份驗證解決方案。[2020/1/24]
君實生物子公司拓普艾萊近日正式獲得FDA關于特異性抗TIGIT單克隆抗體注射液用于治療晚期惡性腫瘤的臨床試驗批準,公司將于近期在美國開展臨床試驗。目前,國內外尚無同類靶點產品獲批上市。
此前,該藥物于2021年1月獲得國家藥監局批準。
華東醫藥全資子公司杭州中美華東與美國ProventionBio公司簽署產品獨家臨床開發及商業化協議。中美華東獲得ProventionBio在研產品——雙特異性抗體PRV-3279兩個臨床適應癥,在大中華區的獨家臨床開發及商業化權益,以上兩個適應癥目前均處在研發過程中。
中美華東將向ProventionBio支付600萬美元首付款,1150萬美元的研發和生產支持經費,最高不超過1.72億美元的里程碑付款,以及約定分級的、兩位數的凈銷售額提成費。
恒瑞醫藥收到國家藥監局核準簽發的關于氟唑帕利膠囊及甲磺酸阿帕替尼片的《藥物臨床試驗批準通知書》,并將于近期開展氟唑帕利聯合阿帕替尼或氟唑帕利單藥治療轉移性去勢抵抗性前列腺癌的開放、多中心、Ⅱ期臨床研究。
除用于鉑敏感的復發性卵巢癌、輸卵管癌或原發性腹膜癌治療外,氟唑帕利膠囊單藥或聯合甲磺酸阿帕替尼片的多個適應癥開發已處在III期臨床研究階段,另有多種聯合治療方案,包括與阿比特龍聯合、與抗PD-L1抗體SHR-1316聯合、以及與替莫唑胺聯合治療多種實體腫瘤已處于臨床開發階段。
廣生堂與泰格醫藥簽訂了《技術服務合同》,委托后者為公司評價GST-HG141片在慢性乙型肝炎患者中多中心、隨機、雙盲、安慰劑對照的多劑量、多次給藥的耐受性、藥代動力學和藥效學Ib期臨床試驗提供服務。公司將借助泰格醫藥的平臺優勢,加快推進GST-HG141的臨床研究進度。
該藥物是全新靶點的抗乙肝病一類新藥,是乙肝核心蛋白抑制劑,可以抑制HBV衣殼的脫殼與組裝。
上海醫藥合資公司上藥博康生物開發的Prolgolimab注射液收到國家藥監局核準簽發的《藥物臨床試驗批準通知書》,該藥物是一種以單克隆IgG1抗體為骨架的全人抗PD-1單抗注射液,由上藥博康于2019年9月License-in。
經上藥博康與國家藥監局藥品審評中心溝通,基于該項目已在俄羅斯上市,國家藥監局同意按照已提交的方案開展III期臨床試驗。
恒瑞醫藥氟唑帕利膠囊已獲得美國FDA國際多中心臨床試驗資格,并將于近期開展相關臨床試驗。該藥物已于2020年12月11日獲得國家藥監局批準用于既往經過二線及以上化療的伴有胚系BRCA突變(gBRCAm)的鉑敏感復發性卵巢癌、輸卵管癌或原發性腹膜癌患者的治療。
動態 | 沙特ATM提供商正在開發基于區塊鏈的生物認證ATM機:據Rttnews報道,沙特阿拉伯ATM提供商Alhamrani Universal正在與基于區塊鏈的身份認證平臺ShoCard合作,開發一種與本地銀行兼容的區塊鏈驅動的生物認證ATM。該原型目前正在進行測試,預計很快將投入生產。該機器將有助于消費者使用基于區塊鏈的應用程序和面部ID認證身份和提取現金。[2019/3/1]
目前,該臨床試驗已在中國、美國獲批開展,后續計劃在澳洲、歐洲、韓國、中國臺灣等國家及地區申請開展國際多中心臨床試驗。
澤璟制藥自主研發產品鹽酸杰克替尼片治療中、高危骨髓纖維化的II期臨床研究取得成功結果。結果顯示,鹽酸杰克替尼片不僅可以顯著縮小骨髓纖維化患者的脾臟體積、減輕患者的體質性癥狀,還可以改善貧血,減少輸血依賴,改善患者的生存質量。
該藥物用于治療骨髓纖維化的研究獲得國家“重大新藥創制”科技重大專項立項支持。目前已在國內上市治療中、高危骨髓纖維化的同類作用機制藥物僅有進口藥物蘆可替尼。
浙江醫藥子公司浙江新碼生物收到國家藥監局核準簽發的注射用重組人源化抗HER2單抗-AS269偶聯物《藥物臨床試驗批準通知書》,同意開展用于胃癌和胃食管連接部腺癌治療的II/III期臨床試驗。
該藥物是公司于2013年6月14日與美國Ambrx公司簽署《合作開發和許可協議》合作研發的新一代單克隆抗體偶聯藥物,用于治療HER2陽性晚期乳腺癌和胃癌等,屬于創新生物技術藥物。
截至2020年12月31日,公司ARX788項目已累計投入研發費用3.45億元。
君實生物收到國家藥監局核準簽發的《受理通知書》,PD-1/TGF-β雙功能融合蛋白JS201注射液的臨床試驗申請獲得受理。該藥物可有效阻斷PD-1/PD-L1和TGF-β免疫抑制通路,改善腫瘤微環境中的免疫調節作用,從而促進人體免疫系統對于腫瘤細胞的殺傷作用,有效增強免疫應答,減少免疫逃逸及耐藥性的發生。目前,國內外尚無同類靶點產品獲批上市。
貝達藥業收到國家藥監局簽發的《藥物臨床試驗批準通知書》,公司申報的BPI-361175片用于治療攜帶EGFRC797S突變及其他EGFR相關突變的晚期非小細胞肺癌等實體瘤的藥品臨床試驗申請已取得國家藥監局批準。
該藥物是一個由貝達藥業自主研發的擁有完全自主知識產權的新分子實體化合物,是一種新型強效、選擇性的第四代表皮生長因子受體口服小分子抑制劑。
恒瑞醫藥子公司蘇州盛迪亞近日收到國家藥監局核準簽發的關于蘋果酸法米替尼膠囊及SHR-1701注射液的《藥物臨床試驗批準通知書》,將于近期開展SHR-1701聯合或不聯合蘋果酸法米替尼治療既往系統化療失敗的廣泛期小細胞肺癌開放、多中心Ⅱ期研究。
日本FiNC公司使用區塊鏈進行行動履歷和生物學管理:日本FiNC公司6月18日宣布使用Blockchain Technologies公司和FiNC公司的應用程序的區塊鏈項目正式啟動,兩方將就使用者的行動履歷和生物學管理,健康狀態等指標使用區塊鏈進行共同開發。[2018/6/19]
蘋果酸法米替尼膠囊是公司創新研發的小分子多靶點酪氨酸激酶抑制劑,目前三款多靶點抑制劑均已在國內獲批上市。截至目前,蘋果酸法米替尼相關項目累計已投入研發費用約為13936萬元。
SHR-1701適應癥以晚期惡性腫瘤為主,國內外尚無同類靶點產品獲批上市。截至目前,相關項目累計已投入研發費用約為15349萬元。
三生國健自主研發的重組抗VEGF人源化單克隆抗體視網膜靜脈阻塞項目II期臨床實驗首例受試者已順利完成入組。該藥物目前正在分別推進4個適應癥的臨床實驗,分別為:視網膜靜脈阻塞、年齡相關性黃斑變性、糖尿病黃斑水腫、病理性近視的脈絡膜新生血管導致的視力損害。截止到2020年12月31日,已累計研發投入金額為1.38億元。
澤璟制藥啟動注射用重組人促甲狀腺激素Ⅲ期臨床試驗,該藥物是是公司自主研發的生物大分子藥物,屬于3類治療用生物制品。
貝達藥業申報的BPI-21668片用于治療晚期實體瘤的藥品臨床試驗申請已獲得國家藥監局批準,該藥物是一個由貝達藥業自主研發的擁有完全自主知識產權的新分子實體化合物,是一種新型強效、高選擇性的磷脂酰肌醇3-激酶α口服小分子抑制劑,擬用于基因突變的晚期實體瘤的治療。
目前,全球僅有一款PI3Kα選擇性抑制劑Alpelisib獲批用于攜帶PIK3CA突變的HR+/HER2-乳腺癌治療,中國區域內尚無PI3Kα選擇性抑制劑上市。BPI-21668屬于“境內外均未上市的創新藥”,其注冊分類為化學藥品1類。
長春高新控股子公司百克生物鼻噴流感減活疫苗獲得藥物臨床試驗批準通知書,同意按照提交的方案開展預防本株病引起的流行性感冒的臨床試驗。
天壇生物控股子公司成都蓉生獲得國家藥監局簽發的《藥物臨床試驗批準通知書》,同意開展“皮下注射人免疫球蛋白”臨床試驗。
德展健康子公司北京東方略的美國合作方Inovio公司宣布了其與東方略聯合研發的一項DNA治療藥物VGX-3100與器械CELLECTRATM5PSP聯合治療HPV-16/18相關宮頸高度鱗狀上皮內病變的首個III期臨床試驗的積極結果,在全部可評估受試者中,達到臨床療效的主要終點和所有次要終點。
VGX-3100是東方略與Inovio公司在DNA免疫治療領域的重點合作開發項目,用于治療由人類乳頭狀瘤病導致的癌前病變,東方略擁有產品在大中華區開發、生產和商業化的獨家權利,目前已經取得中國CFDA的三期臨床試驗批件,正在中國同步開展三期臨床試驗。
VGX-3100一旦獲批上市,將是全球首個被開發用于治療HPV相關癌前病變的非手術治療手段,也是全球第一個DNA藥物。在全球范圍內,這三個適應癥目前均無手術之外的治療方式,藥物治療方面暫為空白。
君實生物JS103注射液的臨床試驗申請獲得國家藥監局核準簽發的《受理通知書》,該藥物公司自主研發的聚乙二醇化尿酸酶衍生物,主要用于高尿酸血癥伴或不伴有痛風的治療,其可通過催化尿酸氧化成溶解度顯著高于尿酸的尿囊素,從而達到降低血尿酸的作用。
華東醫藥全資子公司中美華東收到國家藥監局核準簽發的《受理通知書》,由中美華東和美國MediBeacon公司申報的1類新藥MB-102注射液臨床試驗申請獲得受理。
該藥物是一種用于測量腎小球濾過率的熒光示蹤劑,通過MediBeacon全球首創的TGFR動態監測系統無創監測MB-102產生的熒光信號隨時間的改變,可實時、動態反映GFR,供臨床醫生對患者的腎功能進行即時評估及診斷。
MediBeacon目前已在美國完成了探索性Ⅰ期和Ⅱ期臨床試驗,預計2021年下半年啟動關鍵性III期國際多中心臨床試驗,2022年在美國遞交MediBeaconTGFR動態監測系統的上市申請。
2019年7月13日,公司與MediBeacon達成股權投資及獨家商業化協議,獲得MediBeacon擁有全部產品在中國大陸、香港、臺灣、新加坡、馬來西亞在內的25個亞洲國家或地區的獨家商業化權利。
智飛生物全資子公司北京智飛綠竹研發的組份百白破疫苗近日在湖南常德石門縣疾病預防控制中心開始I期臨床試驗。百白破疫苗是針對百日咳、白喉、破傷風三種疾病的聯合疫苗。
截至目前,國產無細胞百白破疫苗為采用共純化技術制備。智飛綠竹研制的組份百白破疫苗是新一代的無細胞百白破疫苗,采用單獨純化的百日咳有效組份配制出的質量均一疫苗產品,可替代目前免疫規劃疫苗中的百白破疫苗。
恒瑞醫藥近日向FDA提交了注射用卡瑞利珠單抗聯合蘋果酸法米替尼膠囊治療晚期實體瘤的Ⅱ期臨床試驗申請并獲受理。
注射用卡瑞利珠單抗是人源化抗PD-1單克隆抗體,可與人PD-1受體結合并阻斷PD-1/PD-L1通路,恢復機體的抗腫瘤免疫力,從而形成癌癥免疫治療基礎。截至目前,注射用卡瑞利珠單抗相關項目累計已投入研發費用約為141037萬元。
蘋果酸法米替尼膠囊是公司創新研發的小分子多靶點酪氨酸激酶抑制劑。截至目前,蘋果酸法米替尼相關項目累計已投入研發費用約為13936萬元。
海南海藥控股子公司海口市制藥廠近日獲得國家藥監局核準簽發的化學藥品“阿莫西林膠囊”的《藥品補充申請批準通知書》。經審查,本品通過仿制藥質量和療效一致性評價。該藥物主要用于敏感菌所致的成人與兒童的感染性疾病的治療。
華海藥業向美國FDA申報的丙酸氯倍他索外用溶液的新藥簡略申請已獲得批準,該藥物主要用于以治療某些皮膚狀況引起的瘙癢,發紅和腫脹等。
君實生物收到國家藥監局核準簽發的《藥品注冊證書》,特瑞普利單抗用于既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療的新適應癥上市申請獲得附條件批準。鼻咽癌是一種發生于鼻咽部黏膜上皮的惡性腫瘤,是常見的頭頸部惡性腫瘤之一。
百奧泰近日收到國家藥監局核準簽發的關于阿達木單抗注射液《藥品補充申請批準通知書》。該藥品獲批新增適應癥“兒童斑塊狀銀屑病”。
格樂立為公司研發的阿達木單抗生物類似藥,是由CHO細胞表達的重組全人源單克隆抗體。目前,格樂立獲批適應癥為強直性脊柱炎、類風濕關節炎、銀屑病、克羅恩病、葡萄膜炎和兒童斑塊狀銀屑病。
普洛藥業鹽酸美金剛片獲得國家藥監局核準簽發的《藥品注冊批件》,該藥物是用于治療中重度阿爾茨海默癥的藥物,屬于2020年版國家醫保乙類藥物。
康華生物人二倍體狂犬病疫苗在原生產線基礎上增加原液生產車間“病性疫苗二車間”,獲得四川省藥監局《藥品補充申請批件》,下一步需要通過藥品生產質量管理規范符合性檢查并完成《藥品生產許可證》許可事項變更后,方可投產。
樂普醫療全資子公司樂普藥業近日收到國家藥監局核準簽發的《藥品注冊批件》,替格瑞洛片獲得產品注冊批件,“單硝酸異山梨酯緩釋片”通過了仿制藥質量和療效一致性評價。
替格瑞洛是一種環戊基三唑嘧啶類新型口服抗血小板藥物。用于急性冠脈綜合征患者,包括接受藥物治療和經皮冠狀動脈介入治療的患者,降低血栓性心血管事件的發生率。
單硝酸異山梨酯為硝酸異山梨酯的主要活性代謝產物,主要用于治療冠心病的長期治療,心絞痛的長期治療和預防;與洋地黃及利尿劑合用治療慢性充血性心力衰竭。
靈康藥業全資子公司美大制藥收到國家藥監局核準簽發的注射用頭孢唑肟鈉《藥品注冊批件》。該藥物適應癥為敏感菌所致的下呼吸道感染、尿路感染、腹腔感染、盆腔感染、敗血癥、皮膚軟組織感染、骨和關節感染、肺炎鏈球菌或流感嗜血桿菌所致腦膜炎和單純性淋病。
人福醫藥控股子公司宜昌人福收到FDA關于琥珀酸美托洛爾緩釋片的批準文號。琥珀酸美托洛爾緩釋片用于治療高血壓、心絞痛以及伴有左心室收縮功能異常的癥狀穩定的慢性心力衰竭。宜昌人福于2019年提交琥珀酸美托洛爾緩釋片的ANDA申請,累計研發投入約為190萬美元。
濟川藥業全資子公司東科制藥收到國家藥監局核準簽發的宮瘤清片藥品補充申請批準通知書。該藥物是《國家基本醫療保險、工傷保險和生育保險藥品目錄》甲類品種,主治活血逐瘀,消癥破積,用于瘀血內停所致的婦女癥瘕,癥見小腹脹痛、經色紫黯有塊、經行不爽;子宮肌瘤。
昊海生科研制的鹽酸莫西沙星滴眼液用于治療細菌性結膜炎的上市注冊申請獲國家藥監局批準,該藥物為公司自主研發的化學藥品,用于細菌性結膜炎的治療。昊海生科預計將成為國內首個完成本產品仿制藥申請注冊的國產生產商。
三、資金流向
2月1日-3月11日,醫藥生物板塊指數跌幅7.42%。其中,14天上漲,10天收陰,成交量1.92萬億元。單看2月份,跌幅1.61%,指數先是由2月1日的12152.91點整體向上漲至2月18日的最高點13546.62點,隨后進入整體向下的調整期。
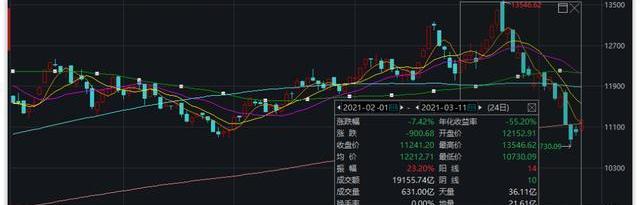
數據來源:Wind資金流向方面,近5個交易日,主力資金凈流出23.48億元。近20個交易日,主力資金凈流出54.78億元。近60個交易日,主力資金凈流入71.89億元。

數據來源:Wind睿藍財訊出品
文章僅供參考市場有風險投資需謹慎
來源:藍籌企業評論
1、XF 有個和link合作的電話透露了出來,然后爆拉了一波,不說項目怎么樣,XF軟件還是很好用的,幣價很小概率歸零.
1900/1/1 0:00:00BrianArmstrong估計早已對公司成立之初遭受的責難風輕云淡。“Coinbase的出現是對比特幣的背叛.
1900/1/1 0:00:00來源:智通財經網 智通財經APP獲悉,2月23日,火幣科技(01611)直接控股公司HuobiGlobalLimited宣布對提幣額度規則進行更新:原“單幣種設置獨立的提幣額度”更新為“全幣種設.
1900/1/1 0:00:00DEX最近再次成為了市場的焦點。賽道龍頭Uniswap、Sushiswap幣價強勢上沖,相繼刷新歷史高點;1inch直接變身“5inch”;DODO等后起之秀同樣表現不俗.
1900/1/1 0:00:00中新網合肥2月20日電(趙強姚淼)記者20日從合肥獲悉,合肥高新近期偵破一起針對虛擬貨幣(泰達幣)的詐騙案,一舉抓獲犯罪嫌疑人7人,扣押涉案現金400萬元.
1900/1/1 0:00:00章永樂|北京大學法學院 2020年末有兩個重大事件,或許將改變世界格局與中國未來:一是已經簽署的全球最大貿易協議RCEP,另一個便是正被美國阻止,但卻即將達成的《中歐投資協定》.
1900/1/1 0:00:00